現(xiàn)階段��,很多學(xué)生已經(jīng)進(jìn)入初三化學(xué)下冊的學(xué)習(xí),或者是在即將來臨的寒假期間準(zhǔn)備預(yù)習(xí),這時(shí)候都將接觸到中考化學(xué)中所占分值最多的酸堿鹽。其中�����,復(fù)分解反應(yīng)����,作為四大基本化學(xué)反應(yīng)之一����,無疑是中考的重點(diǎn)及難點(diǎn)。而常見酸堿鹽的溶解性則是判斷復(fù)分解反應(yīng)能否發(fā)生的重要依據(jù)��。
如果你是中考生��,這張常見酸堿鹽溶解性表��,除了背下來����,你別無選擇。
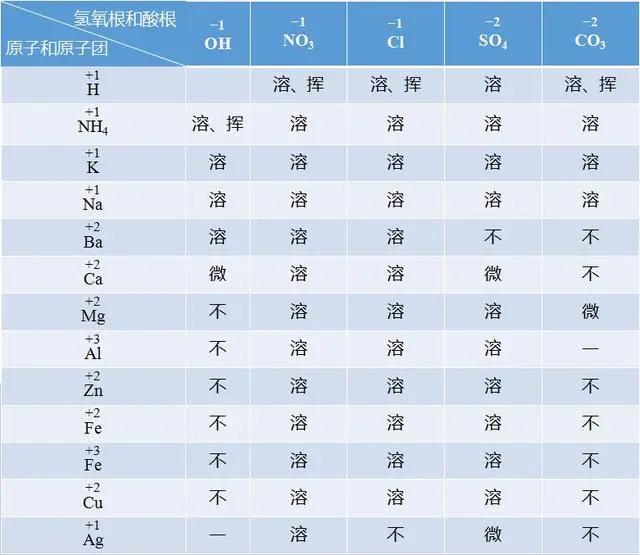
1.酸:氫離子和各酸根離子構(gòu)成酸�����,都是可溶的。
注意:硝酸(HNO3)�����,鹽酸(HCl)以及硫酸(H2SO4)屬于三大強(qiáng)酸����,碳酸(H2CO3)則屬于弱酸。除了濃硫酸具有吸水性��,另外三種酸都具有揮發(fā)性����。
2.堿:由金屬元素或銨根與氫氧根組成的化合物,稱為堿�����。記住常見的堿中可溶性的堿����,五個(gè)字:“鉀鈉鈣鋇銨”【KOH�����、NaOH、Ca(OH)2�����、Ba(OH)2��、NH3∙H2O】都是可溶性的堿��。
補(bǔ)充:氫氧化鈣微溶于水��,也就是我們經(jīng)常提到的澄清石灰水����,氫氧化銅是藍(lán)色絮狀沉淀,氫氧化鐵是紅棕色的絮狀沉淀��。物質(zhì)的特性�����,在推斷題中常作為物質(zhì)的信息點(diǎn)和突破口��。

Cu(OH)2沉淀

Fe(OH)3沉淀
前方高能!重!點(diǎn)!來!了!
3.鹽:金屬離子(或銨根)與酸根離子構(gòu)成的化合物
3.1.三個(gè)字——“鉀鈉銨”��。
在鹽的分類中,根據(jù)鹽中金屬元素(或銨根) 的種類�����,鹽可以分為鉀鹽(KCl����、K2CO3、K2SO4)��,鈉鹽(NaCl�����、Na2CO3��、NaNO3)��,銨鹽(NH4Cl����、NH4NO3、NH4HCO3)等����。
由鉀、鈉��、銨【K����、Na、NH4】組成的鹽��,一定都是可溶的�����,以上已舉例��。
3.2.三個(gè)字——“三強(qiáng)酸”
找三強(qiáng)酸的酸根��,前面講到三大強(qiáng)酸����,分別是硝酸,鹽酸����,和硫酸。當(dāng)鹽中有鹽酸根(Cl−)�����,硫酸根(SO42−),硝酸根(NO3−)的時(shí)候��,都是可溶的��。比如:NaCl�����、Na2SO4����、NaNO3。
但是!但是!記住兩個(gè)挑事兒的特例
①含有鹽酸根(Cl−)的鹽當(dāng)中��,氯化銀(AgCl)是不可溶的白色沉淀;
②含有硫酸根(SO42−)的鹽中����,硫酸鋇(BaSO4)是不可溶的白色沉淀;
這兩個(gè)是含有三強(qiáng)酸酸根的常見鹽當(dāng)中唯一兩個(gè)不可溶的堿。
所以��,如果某種鹽中既沒有鉀鈉銨��,也沒有三強(qiáng)酸酸根��,則該種鹽為不可溶性鹽。你也會(huì)發(fā)現(xiàn)��,大部分的碳酸鹽����,都是不可溶的��。
下面你可以花30s時(shí)間來記住以上幾點(diǎn)����。
然后檢查一下自己是否有理解和記住:判斷以下三種物質(zhì)的溶解性:
(1) MgSO4 (2) BaCO3 (3) Mg(OH)2
(1) MgSO4:屬于鹽����,以三強(qiáng)酸中的硫酸根結(jié)尾,為可溶性鹽;
(2) BaCO3:屬于鹽��,沒有鉀鈉銨��,也沒有三強(qiáng)酸的酸根����,為不可溶性鹽;
(3) Mg(OH)2:屬于堿,非“鉀鈉鈣鋇銨”其中之一��,為不可溶性堿。
歡迎使用手機(jī)����、平板等移動(dòng)設(shè)備訪問中考網(wǎng),2024中考一路陪伴同行��!>>點(diǎn)擊查看









